歐盟MDR下的新指南
醫療器械協調小組(MDCG)根據醫療器械法規(MDR)和體外診斷器械法規(IVDR)發布了兩個新的指導文件。這些涉及新的醫療器械法規(MDR)所要求的“負責法規遵從的人員”和“植入卡”。
這些是MDCG發布的最新指南,并在該法規于2020年5月(對于醫療器械)和2022年5月(對于體外診斷醫療器械)生效之前在歐洲委員會的網站上整理。
監管合規負責人
根據MDR的第15條和IVDR的第15條,“ 制造商應在其組織內至少配備一名負責監管合規的人員,這些人員具有醫療設備領域的必要專業知識。”雖然法規對醫療器械的要求做出了規定。在PRRC和自己的責任的概述的資格,在指導增加了額外的細節,這些要求,并明確了制造商PRRC要求及授權代表(AR),尤其是:
每個合法制造商都必須擁有PRRC可供使用,并且如果組織中有多個合法制造商,則每個制造商都必須擁有自己的PRRC。該指南并未闡明同一PRRC是否可以為多個制造商提供服務。
未在歐盟成立的制造商必須在歐盟成員國內擁有AR,而后者還必須具有PRRC。AR還可以將PRRC的職責分包給第三方。制造商和AR的PRRC不能是一個人,對于小型或小型企業,制造商的PRRC和AR的PRRC不能來自同一外部組織。
就位置而言,PRRC應與制造商或AR位于同一地點。因此,如果制造商位于歐盟以外,則PRRC也應位于歐盟以外。歐盟的制造商也應在歐盟內部設有PRRC。由于AR將位于歐盟內,因此PRRC也將位于歐盟內。
如果PRRC的要求資格未在歐盟獲得,則應由歐盟成員國認可,等同于歐盟相應的資格。
微型或小型企業可以將PRRC的責任分包給第三方,但前提是PRRC具有相關資格,并且制造商可以證明他們能夠使用非制造商組織內的第三方來履行其法律義務。
請注意,該指南并未提及制造商或PRRC可能承擔的違反PRRC責任或兩個實體之間關系的潛在責任。這可以在國家執行耐多藥和IVDR中解決。但是,這種不清晰會影響公司為MDR做準備。
植入卡
根據MDR第18條,可植入設備的制造商應向該設備提供植入卡(IC),以允許識別該設備以及其他關鍵信息。此外,會員國應要求醫療機構將某些信息作為IC的一部分提供。盡管MDR中包含了IC的預期目的和許多必需的元素,但是IC 指南更進一步,包括數據元素的更多詳細信息,并提供了應如何顯示此信息的示例。
根據MDR,制造商必須隨IC提供以下信息:
2.序列號,批號;
3.唯一設備標識(UDI);
4.制造商的名稱,地址和網站;
5.設備類型。
該信息最好應在卡本身上,或作為臨床醫生要粘貼的標簽,盡管在指南中不建議這樣做。IC還應包含空白字段,以供醫療保健提供者填寫以下信息:
1.患者姓名或患者ID;
2.進行植入的醫療機構的名稱和地址;
3.植入日期。
IC的尺寸應為信yong卡尺寸,該指南還建議您使用符號以避免使用IC的國家版本,并包含可用于某些數據字段的經過驗證的符號列表。建議使用說明手冊以相關成員國的語言解釋符號。最后,它建議了植入卡和相應傳單的一些設計。以下是指南中提供的許多示例之一:
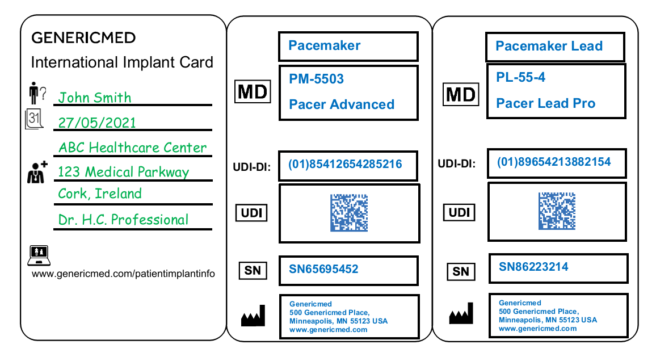
這些實際示例至少在MDR的這一方面可能會為公司提供急需的清晰度,并且將成為有助于IC設計和生產的有用工具。









